
产品描述:
本产品为一款可针对不同物种植物叶片、种子等样本进行直接 PCR 扩增的试剂盒,免去了繁琐的核酸提取纯化过程, 可用于植物转基因检测及植物基因分型。试剂盒中使用了经过定向改造的直扩型 DNA Polymerase,对植物样本中的 PCR 抑制物具有极强的耐受性,并保持较高的灵敏度和特异性。试剂盒中独特的 Lysis Buffer 可快速裂解各种类型植物组织,释放出基因组 DNA,裂解产物可直接作为 PCR 反应模 板使用。
本产品为一种 2×浓度的预混试剂, 操作简单并减少了污染的可能性,可实现高通量检测。2×预混试剂中包含了 PCR 反应所需要的 DNA 聚合酶、 dNTP、 Mg2+、缓冲液和增强剂等成分,只需要向其中加入引物和模板即可进行 PCR 反应,同时包含电泳 Loading Buffer 以方便在 PCR 完成后直接进行电泳检测。
针对多糖、多酚类植物样本,若本产品得不到理想扩增效果,可选用专门针对多糖、多酚植物样本的直扩试剂盒——快速植物直扩 Plus PCR 试剂盒。
产品特点
1. 无需进行核酸提取或纯化,直接对样本进行 PCR 扩增反应;
2. 产品中含有 Loading Buffer ,PCR 产物可直接进行电泳检测;
3. 扩增速度可以达到 30sec/kb,大大缩短检测时间
4. 扩增产物中 3’端加“A”碱基并纯化后可直接用于 TA 克隆。
实验流程
一、样本制备
1. 植物叶片样品制备
可选择如下方式之一进行样本制备:
1) 组织研磨法
使用组织研磨仪研磨:剪取 3-5 mm 尺寸的新鲜幼嫩的叶片于深孔板(或 EP 管)中,向深孔板(EP 管)中加入 150-200µL Buffer RLB18,加入两颗钢珠(自备),盖上硅胶盖(或 EP 管盖),置于组织研磨仪上研磨 1-2 min。
然后,置于平板离心机上于 4,000×RPM 下离心 1-2 min (建议 4℃下进行离心),离心后上清液可直接作为 PCR反应模板使用。
使用研钵研磨:剪取 3-5 mm 尺寸的新鲜幼嫩的叶片于研钵中,向其中加入 200 µL Buffer RLB18,用 研磨棒充分磨碎后置于离心机上于 12,000×RPM 离心 1-2 min(建议 4℃下进行离心),离心后上清液可直接作为 PCR 反应模板使用。
2) 加热裂解法
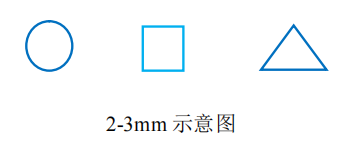
剪取 2-3 mm 尺寸新鲜幼嫩的叶片于 200 µL EP 管(或 96 孔 PCR 板)中, 向 EP 管(或 PCR 板)中加入 50µL Buffer RLB18 (Buffer RLB18 务必淹没叶片) ,盖上管盖,在烘箱、水浴锅或者 PCR 仪上于 95℃加热处理 5-10 min,然后置于台式离心机上于 12,000×RPM 下离心 1-2 min(或平板离心机上于 3,000 ×RPM 离心 1-2min),建议 4 下进行离心,离心后上清液可直接作为 PCR 反应模板使用。
样本制备注意事项:
a) 请务必参照示意图所示尺寸剪取叶片用量,并尽量不要取到叶脉;
b) 为避免交叉污染,减取样品的工具每次取样后需洗刷后方可进行下一样品的取样;
c) 有条件的情况下建议优先采用组织研磨法进行样本制备,使用组织研磨仪 时预先摸索破碎条件,包括转速/频率和研磨时间,研磨后看不到大块叶片即为研磨成功;
d) 样本如需长期保存,请将上清液(吸取上清是尽量不要吸取到底部的沉淀)置于-20℃保存,短时间保存(<1 hr)可置于 4℃放置。
2. 植物种子样品制备
1) 组织研磨法
参照表 1 建议的用量, 将植物种子加入到 Buffer RLB18 中进行充分研磨,然后置于离心机上于12,000×RPM 下离心 1-2 min,上清液即可直接作为 PCR 反应模板使用。
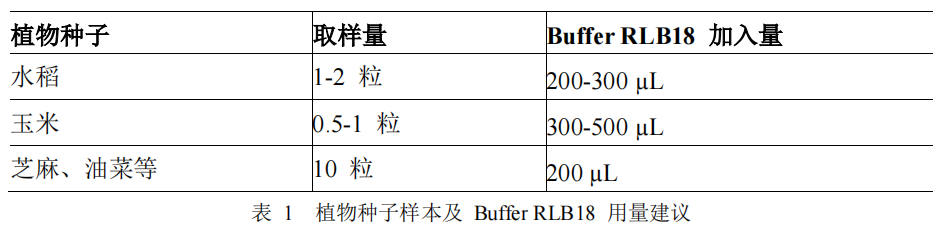
表 1 植物种子样本及 Buffer RLB18 用量建议
对于需要进行萌发实验的种子,切取 5-10mg 组织(切勿取到种胚),置于 150-200 µL Buffer RLB18中,充分研磨后置于离心机上于 12,000×RPM 下离心 1-2 min,所得上清液即可直接作为 PCR 反应模板使用。
2) 加热裂解法
参照表 1 建议的用量,将植物种子加入到 Buffer RLB18 中,置于 95℃处理 10-15 min(针对较难裂解的样本可适当延长加热处理时间) ,然后于 12,000×RPM 下离心 1-2 min,所得上清液即可直接作为 PCR 反应模板使用。
对于需要进行萌发实验的种子,切取 5-10mg 组织(切勿取到种胚),置于 150-200 µL Buffer RLB18中,置于 95℃处理 10-15min(针对较难裂解的样本可适当延长加热处理时间),加热结束后于 12,000×RPM下离心 1-2min,所得上清液即可直接作为 PCR 反应模板使用。
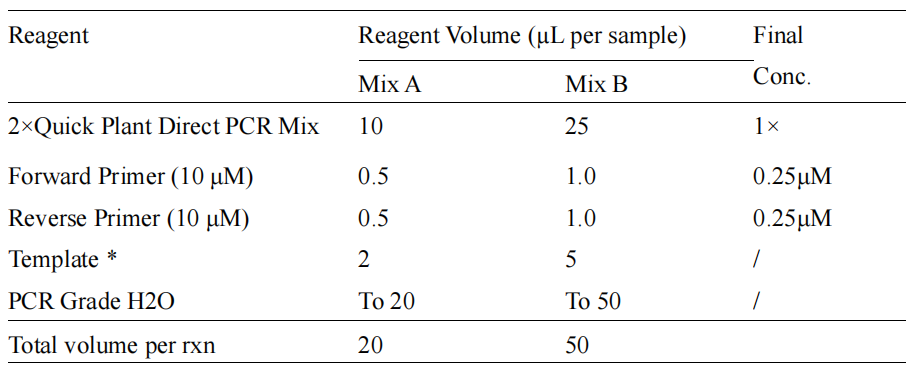
二、扩增体系和条件
1. 反应体系制备
*: DNA 模板加入量建议为反应总体积的 10-20%
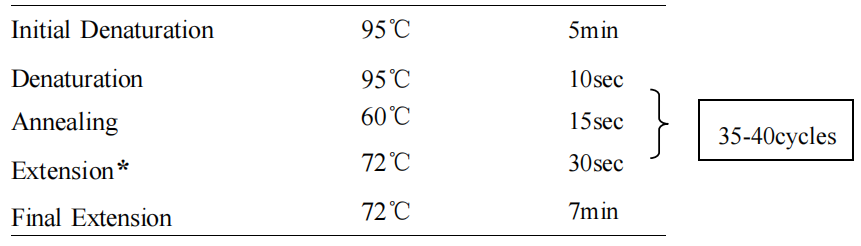
2. 反应程序
*: Extension 延伸速度 15-30sec/kb。
3. 检测
直接吸取 10µL PCR 产物于 1-1.5%的琼脂糖胶上进行电泳检测。
应用实例
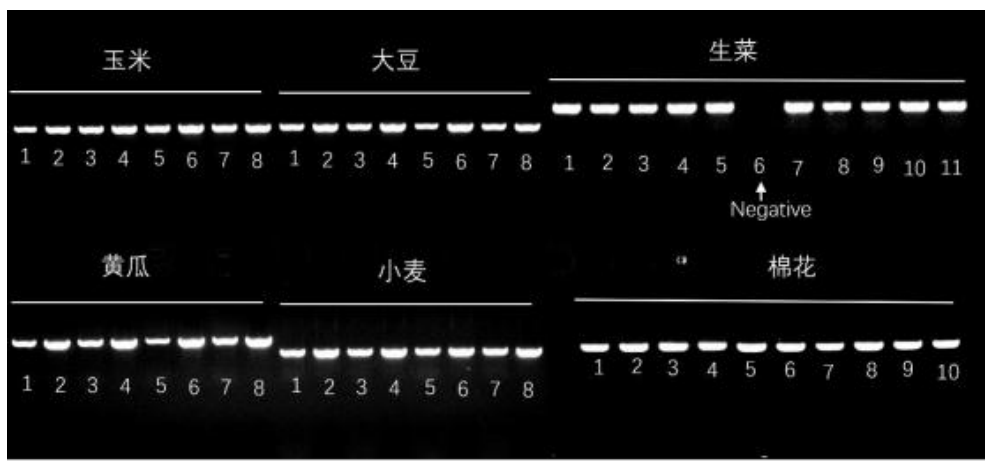
使用本试剂盒对玉米、大豆、 黄瓜、小麦、生菜、田菁等物种的不同叶片进行直接 PCR 扩增实验, 扩增产物的琼脂糖凝胶电泳结果如下图所示:
35-40cycles样本制备方法:研磨法
 注意事项
注意事项
1. 产品解冻需要在冰上进行,并避免反复冻融;
2. 使用前上下轻柔颠倒试剂瓶数次,确保各试剂成份完全混匀,未混匀试剂反应性能会有所下降;
3. PCR 反应配制过程需在冰上进行,各成份加毕后请短暂涡旋混匀并离心;
4. 请仔细阅读本说明,严格按照操作流程和推荐用量使用本产品;
5. 本产品仅供科学研究使用,不可用于临床诊断。



 收藏
收藏






 电话咨询
电话咨询
 在线咨询
在线咨询
 QQ
QQ
 二维码
二维码
 扫码二维码
扫码二维码