

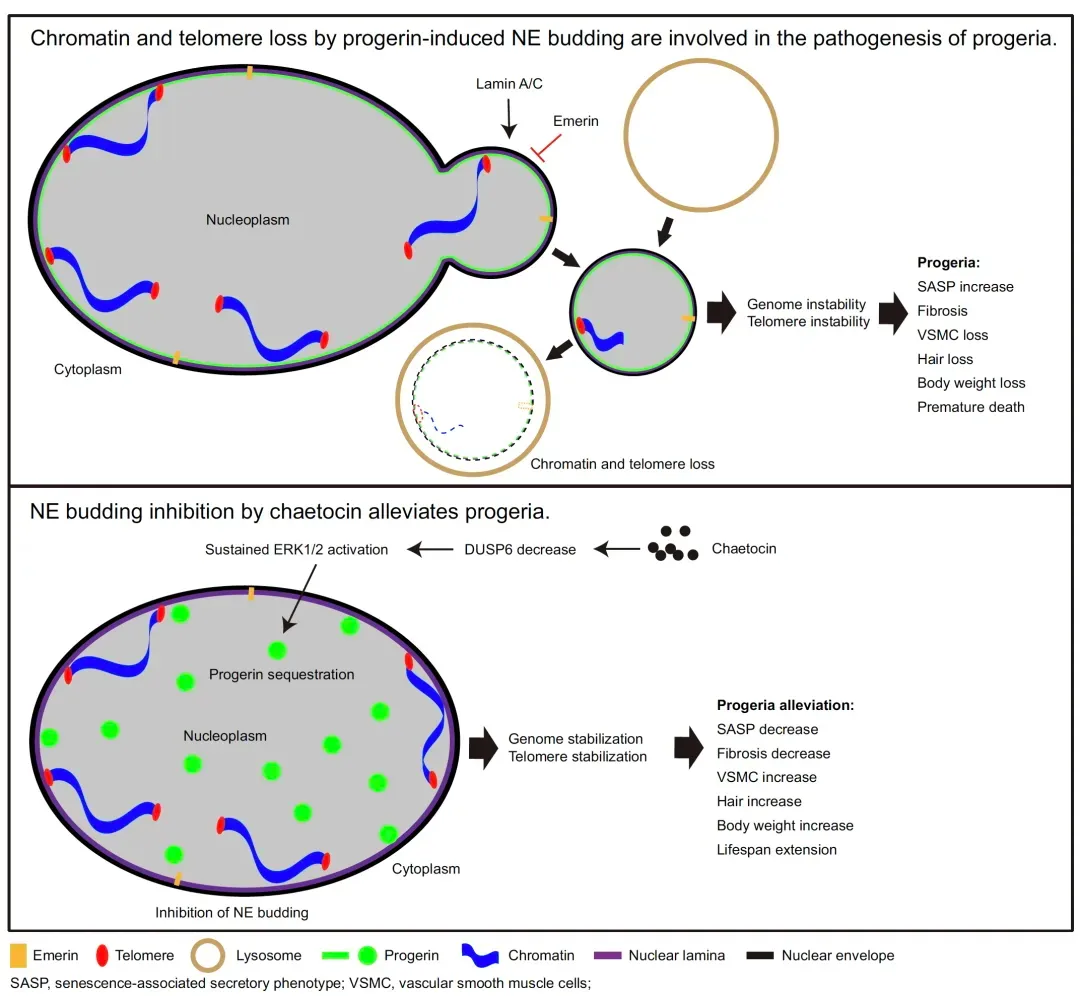
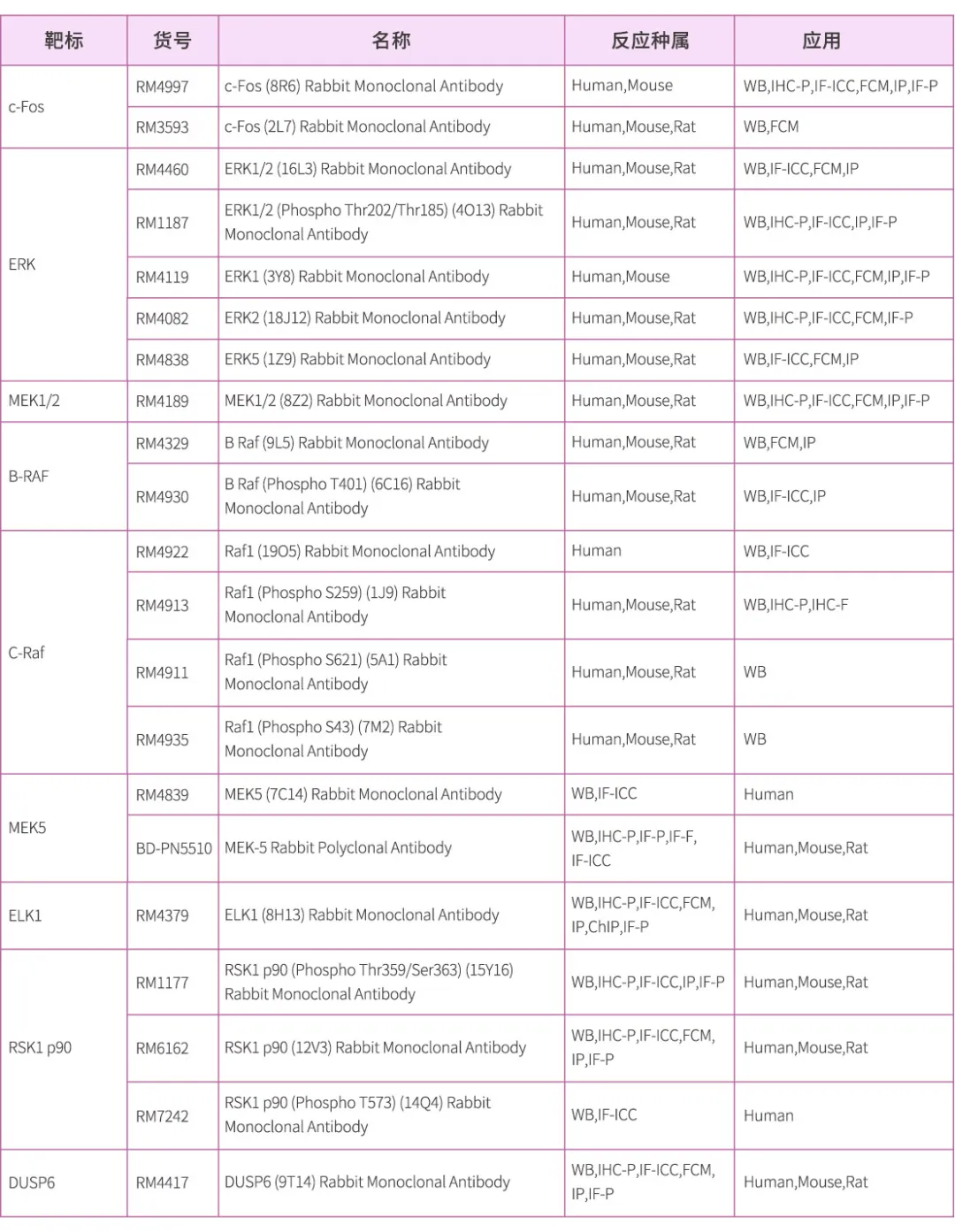

公司主要产品有抗体制备全套产品、病毒包装 相关产品、2万多种科研用抗原抗体、近300 种病理级抗体、几千种重组蛋白,另有WB、 IHC、ELISA、细胞培养相关试剂及诸多特色 产品和特色技术服务。
 电话咨询
电话咨询
 在线咨询
在线咨询
 QQ
QQ
 二维码
二维码
 扫码二维码
扫码二维码