
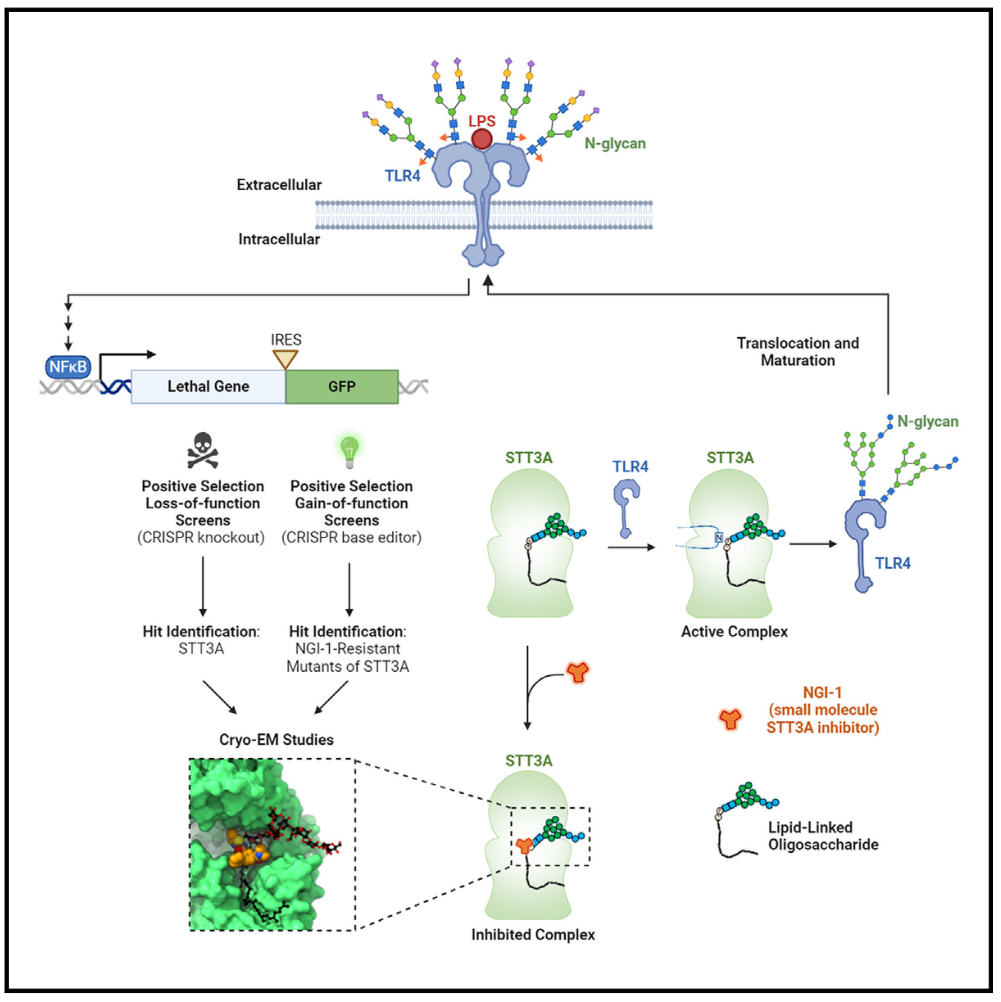
近日,来自美国丹娜-法伯癌症研究所的William G. Kaelin, Jr.与瑞士苏黎世理工大学的Kaspar P. Locher共同在Cell期刊发表题为Positive selection CRISPR screens and cryo-EM reveal a druggable pocket in an oligosaccharyltransferase required for inflammatory signaling to NF-κB(通过正向CRISPR筛选和冷冻电子显微镜揭示NF-κB促炎信号传递所需的寡糖转移酶中的成药口袋)的文章。研究表明,LPS等促炎信号通过TLR4激活NF-κB,而TLR4依赖于寡糖转移酶复合物OST-A进行糖基化和细胞定位。NGI-1通过非竞争性抑制OST-A的STT3A亚基,阻止NF-κB信号传导。这项研究为开发STT3A特异性抑制剂提供了理论基础和方法,突显了通过碱基编辑和结构研究揭示药物作用机制的重要性。

研究人员利用正向遗传筛选,旨在确定能够使LPS诱导的NF-κB信号传导通路失活的基因。研究设计了一种双报告基因系统,利用NF-κB转录因子驱动自杀基因和绿色荧光蛋白(GFP)的表达,便于进行正向筛选。
LPS激活NF-κB信号通路的必需基因筛选
首先,研究人员构建了一种慢病毒,携带改良的脱氧胞苷激酶(DCK*)和GFP,其基因表达由人工NF-κB响应性启动子调控。通过这种方法,他们能够调控NF-κB信号通路的活性,影响细胞对毒素溴乙烯脱氧尿苷(BVdU)的敏感性。荧光激活细胞分选技术证实了NF-κB活性对DCK*和GFP表达的影响。通过CRISPR-Cas9技术失活内源性NF-κB抑制剂TNFAIP3,进一步增强了实验结果的动态范围。研究表明,NF-κB活性增加使细胞对BVdU更敏感,反之亦然。DCK*表达的差异反映了BVdU敏感性的变化。接着,研究人员鉴定了LPS激活NF-κB通路的必需基因。他们发现,与对照组TNFAIP3-/- UBC-DCK*相比,TNFAIP3-/- NF-κB-DCK*筛选结果显示与LPS激活NF-κB通路相关的热点基因,包括TLR4。对前500个热点基因的进一步筛选结果显示,部分基因在不同NF-κB激动剂处理的细胞中表现出特异性富集,而其他基因则在三种激动剂处理中均有富集。特别是CpG受体TLR9和TNF受体在筛选中表现出色。研究还发现OST-A催化亚基STT3A,以及另外两个基因DC2和CCDC134是LPS筛选中的关键扰动因素。进一步的研究表明,STT3A或CCDC134的失活会降低细胞表面的TLR4水平,导致HSP90B1(TLR4折叠和运输到细胞表面所需的分子伴侣)的下调。实验结果显示,STT3A、DC2和CCDC134的灭活减弱了LPS和CpG对NF-κB的激活,但对TNF-α的影响较小。
OST-A调控TLR4糖基化和细胞表面定位
TLR4含有九个N-糖基化序列,其中两个(Asn526和Asn575)对于TLR4的细胞表面定位至关重要。通过免疫印迹分析,研究人员确认了TLR4的糖基化状态,并发现STT3A、CCDC134和HSP90B1的缺失会导致TLR4的糖基化水平降低。他们还发现,细胞缺乏OST-A会显著减少TLR4的糖基化,而OST-B缺失则没有影响。这表明OST-A在控制TLR4的糖基化和NF-κB信号传导中发挥着特定作用。实验还表明,在小鼠细胞中,STT3A对内源性和外源性TLR4的调节至关重要。当TLR4缺失时,LPS无法激活NF-κB信号传导。此外,利用CD16-TLR4融合蛋白,研究人员还证明TLR4在细胞表面定位参与NF-κB激活,但是这与STT3A无关。因此,在内源性STT3A敲除的细胞中重新引入野生型STT3A,可以挽救TLR4的糖基化。研究人员还发现,一种名为NGI-1的化合物可以抑制OST酶的活性,进而降低TLR4的糖基化水平和LPS诱导的iNOS表达,但对其他蛋白质也有影响。另一种针对OST-A的特异性抑制剂,NGI-235化合物可以选择性地抑制TLR4的糖基化和细胞表面定位,对其他蛋白质的影响较小。这表明NGI-235是一种原型药物,可以抑制OST-A,减弱NF-κB信号传导。
NGI-1与OST-A的相互作用
接下来,研究人员使用NGI-1进一步探究其与OST-A的相互作用以及对TLR4的影响。实验结果表明,NGI-1处理降低了细胞表面TLR4水平和糖基化,但引入特定的STT3A突变体(如F256P、Q260R、E266K和Y331H)可以恢复这些效应,并表现出对NGI-1的抗性。由于这些突变体不会影响STT3A的催化活性,所以可以恢复TLR4的表达水平,特异作用于TLR4。通过研究人类OST-A结构,研究人员确定了NGI-1与STT3A的结合位点和相互作用。他们观察到NGI-1与STT3A的结合,确定了关键的残基如Phe256、Phe330、Gln260和Glu266在NGI-1识别中的作用。突变体研究揭示了这些残基的重要性,例如Glu266和Phe256的变异会导致严重的NGI-1耐药性。一些突变可能会改变结合口袋的拓扑结构,进而影响NGI-1的结合。先前的研究表明,OST的催化循环可以通过结合受体蛋白的序列(“肽引导”)或结合供体LLO Dol-PP-GlcNAc2-Man9-Glc3(“LLO引导”)来启动。NGI-1结合的OST-A结构显示了LLO的几何构型变化。NGI-1阻止了LLO与焦磷酸根的静电相互作用,稳定了LLO的结合。NGI-1类似非竞争性抑制剂,通过改变OST-A的构象来阻碍其催化活性。此外,NGI-1促进了LLO的共纯化,增强了LLO对与OST-A的亲和力,被视为LLO的协同抑制剂。总之,研究人员通过对NGI-1与OST-A相互作用的研究,揭示了其在TLR4糖基化和NF-κB信号传导中的重要性,并为药物设计提供了重要线索。
综上所述,该研究通过一种创新的方法识别了可成药的糖基化过程,该糖基化过程与TLR4介导的炎症转录因子NF-κB的活化相关。研究为针对NF-κB信号通路的药物开发提供了新的见解。
原文链接:https://doi.org/10.1016/j.cell.2024.03.022
制版人:十一
参考文献
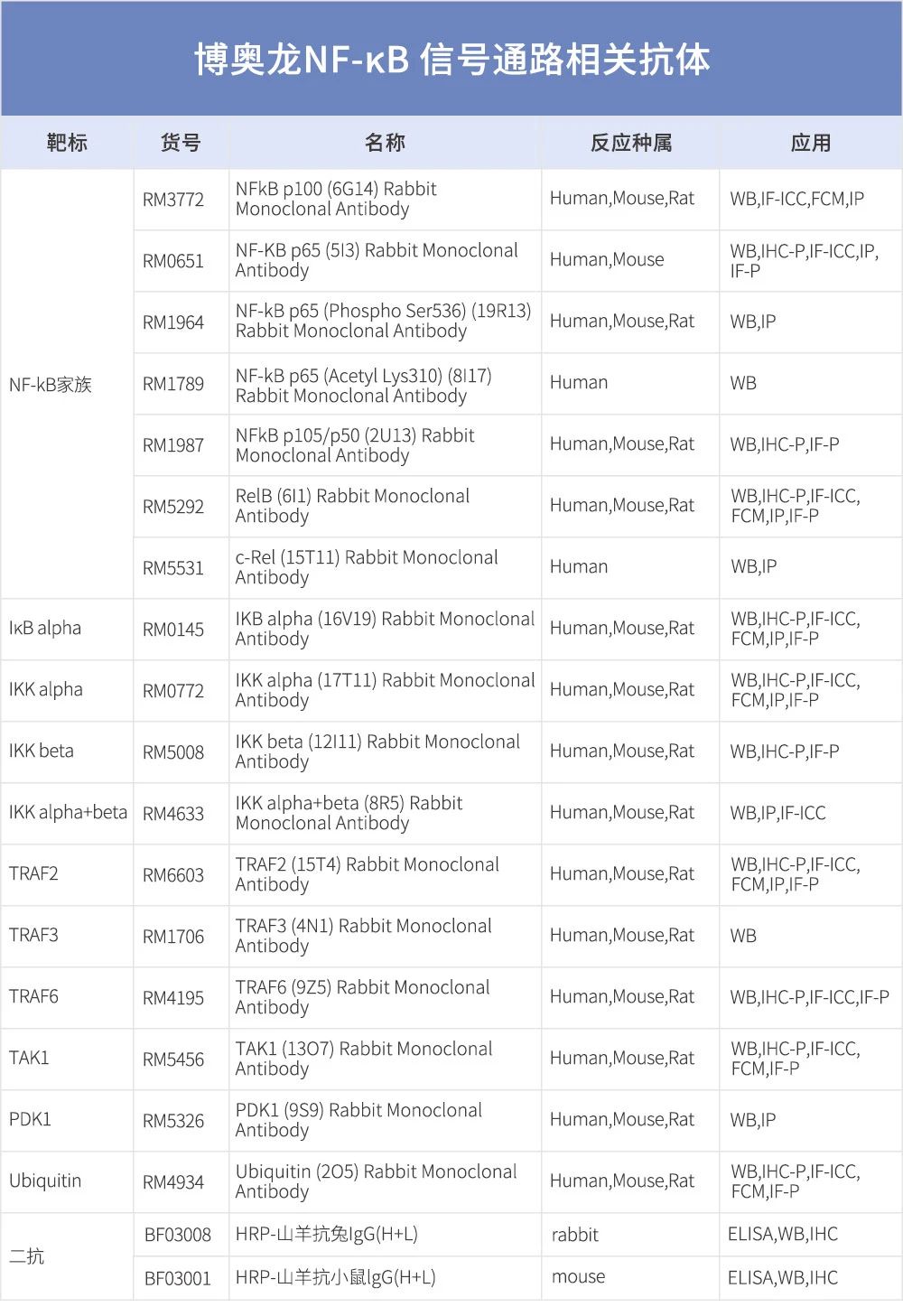
1. Napetschnig, J., and Wu, H. (2013). Molecular basis of NF-κB signaling. Annu. Rev. Biophys. 42, 443-468. https://doi.org/10.1146/annurev-biophys-083012-130338.
2. Oeckinghaus, A., and Ghosh, S. (2009). The NF-κB family of transcription factors and its regulation. Cold Spring Harb. Perspect. Biol. 1, a000034. https://doi.org/10.1101/cshperspect.a000034.
3. Sun, S.C., Chang, J.H., and Jin, J. (2013). Regulation of nuclear factor-kB in autoimmunity. Trends Immunol. 34, 282-289. https://doi.org/10.1016/j. it.2013.01.004.
4. Brenner, D., Blaser, H., and Mak, T.W. (2015). Regulation of tumour necrosis factor signalling: live or let die. Nat. Rev. Immunol. 15, 362-374. https://doi.org/10.1038/nri3834.

公司主要产品有抗体制备全套产品、病毒包装 相关产品、2万多种科研用抗原抗体、近300 种病理级抗体、几千种重组蛋白,另有WB、 IHC、ELISA、细胞培养相关试剂及诸多特色 产品和特色技术服务。
 电话咨询
电话咨询
 在线咨询
在线咨询
 QQ
QQ
 二维码
二维码
 扫码二维码
扫码二维码